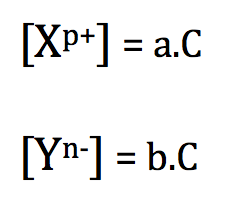Solutions Électrolytiques
I - Les solutions Électrolytiques
Une solution électrolytique est :
- Obtenue en dissolvant un soluté dans un solvant
- Une solution contenant des ions
- Conductrice de courant
- Électriquement neutre
Solide ionique
Un solide ionique est :
- Formé d'ions (cations + anions) disposés de manière régulière dans l'espace et qui forment une structure solide appelée cristal
- Solide car sa cohésion est assurée par des interactions électriques entre les ions
- Électriquement neutre : il contient autant de charge positive (cations) que négative (anion)
On lui attribue une formule statistique qui traduit cette neutralité électrique
Mise en solution
D'un solide ionique
Lors de la mise en solution aqueuse d'un solide ionique, l'eau détruit le cristal et libère les ions :
exemple :
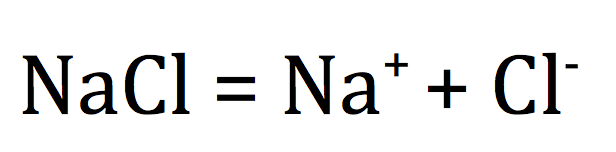
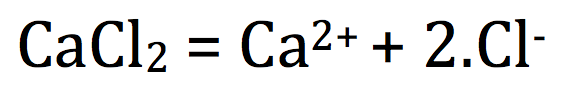
D'un liquide
Certains liquides donnent des ions lors de leurs mise en solution aqueuse ; c'est le cas de l'acide sulfurique
exemple :
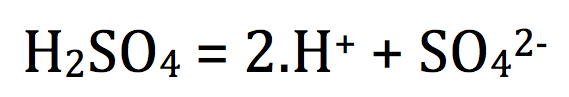
D'un gaz
Certains gaz à pression et température ordinaire se dissolvent très facilemet dans l'eau ; c'est le cas du chlorure d'hydrogène
exemple :
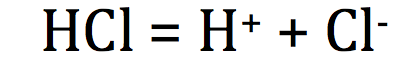
II - Caractère polaire de certaines molécules
Électronégativité
L'électronégativité d'un élément est la tendance d'un atome de cet élément à attirer le doublet d'une liaison covalente dans laquelle il est engagé
Liaison polaire
Lorsqu'une laision covalente relie un atome A plus électronégatif qu'un atome B, alors la liaison A-B est polaire.
Molécule polaire
Pour déterminer le caractère polaire ou apolaire d'une molécule, on commence par étudier la polarité éventuelle de chaque liaison.
Si le centre géométrique (= barycentre) des charges partielles δ+ et celui des charges partielles δ- ne coïncident pas, la molécule est polaire. S'ils sont confondus, la molécule est apolaire.
exemple : Étude de la molécule d'eau H20
L'électronégativité de l'oxygène xO est plus que celle de l'hydrogène xH. Les liaisons O-H de la molécule d'eau sont polarisées de telle façon que l'oxygène porte une densité électrique négative (2δ-) et que chaque hydrogène porte une densité électrique (δ+)
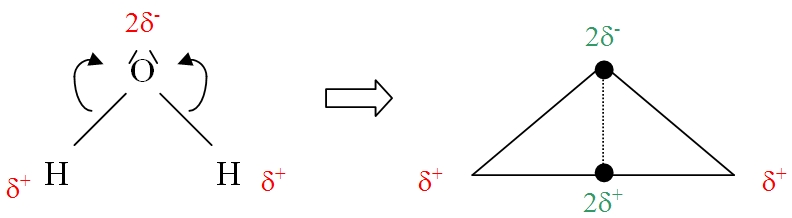
Le barycentre des densités électriques positives se situe au milieu du segment joignant les deux atomes d'hydrogène (voir figure).
Il apparaît alors qu'étant donnée la géométrie de la molécule d'eau, les barycentres des destinés électriques positives et négatives sont distincts. La molécule d'eau présente un caractère polaire.
Ce caractère polaire de la molécule d'eau lui confère des propriétés de solvant très particulier.
III - Dissolution
Solvation des ions en solutions
L'eau a donc pour propriété de détruire les solides ioniques et de disperser les ions. Ces phénomènes s'accompagnent du phénomène de solvation des ions.
Cette solvation est due au caractère polaire de l'eau :
- Les ions positifs (cations) en solution attirent (interaction électrique) les molécule d'eaux par leur partie négative → Chaque cation s'entoure d'un certain nombre de molécules d'eau
- Les ions négatifs (anions) en solution attirent (interaction électrique) les molécules d'eaux par leur partie positive → Chaque anion s'entoure d'un certain nombre de molécules d'eau
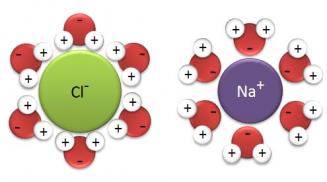
→ Ce phénomène est appelé solvation des ions
Lorsque le solvant est l'eau, la solvation est appelée hydratation ; les ion shydratés sont notés avec le symbole (aq) en indice.
Cas particulier du Proton H+
Le proton H+ s'associe par une véritable liaison à une molécule d'eau pour former l'ion oxonium H30+
Cet ion oxonium est lui-même solvaté ou hydraté
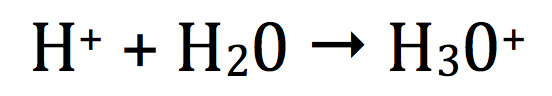
Écriture des équations de mise en solution aqueuse
Compte tenu du phénomène de solvation ou d'hydratation, les équations de mise en solution aqueuse doivent être réécrite sous la forme :
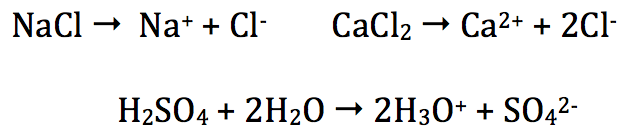
Concentration molaire
- Dans une solution :
La concentration molaire représente la quantité de matière de soluté X dissoute par litre de solution
c = n / V
Tel que c : concentration molaire (mol/L) ; n : quantité de matière (mol) ; V : volume de solution (L)
- Dans une espèce dissoute :
Si une espèce X est effectivement présente en solution, la concentration [X] de cette espèce est la quantité de matière nX de cette espèce présente par litre de solution
[X] = nx / V
Tel que [X] : concentration molaire de l'espèce X (mol/L) ; nx : quantité de matière de l'espèce X mis en solution (mol) ; V : volume de la solution (L)
Relation entre les concentrations
Cas général :
Soit une solution du solide ionique XaYb de concentration C. L'équation de mise en solution aqueuse de ce solide ionique s'écrit :
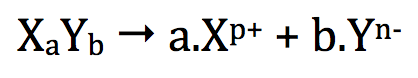
On a alors :